ფთორი
| ფთორი |
| 9F |
| 18.998 |
| 2s2 2p5 |
ფთორი[1][2] (ლათ. Fluorum; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეორე პერიოდის, მეჩვიდმეტე ჯგუფის (მოძველებული კლასიფიკაციით — მეშვიდე ჯგუფის მთავარი ქვეჯგუფის, VIIა) ქიმიური ელემენტი. მისი ატომური ნომერია — 9, ატომური მასა — 18.998.
 | |||||||||||||||||
| ზოგადი თვისებები | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| სტანდ. ატომური წონა Ar°(F) |
18.998403162±0.000000005 18.998±0.001 (დარგვალებული) | ||||||||||||||||
| ფთორი პერიოდულ სისტემაში | |||||||||||||||||
| |||||||||||||||||
| ატომური ნომერი (Z) | 9 | ||||||||||||||||
| ჯგუფი | 17 ჯგუფი (ჰალოგენები) | ||||||||||||||||
| პერიოდი | 2 პერიოდი | ||||||||||||||||
| ბლოკი |
| ||||||||||||||||
| ელექტრონული კონფიგურაცია | [He] 2s2 2p5 | ||||||||||||||||
| ელექტრონი გარსზე | 2, 7 | ||||||||||||||||
ელემენტის ატომის სქემა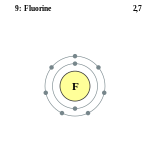 | |||||||||||||||||
| ფიზიკური თვისებები | |||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | აირი | ||||||||||||||||
| დნობის ტემპერატურა |
(F2) −219.67 °C (53.48 K, −363.41 °F) | ||||||||||||||||
| დუღილის ტემპერატურა |
(F2) −188.11 °C (85.03 K, −306.60 °F) | ||||||||||||||||
| სიმკვრივე (ნსპ) | 1.696 გ/ლ | ||||||||||||||||
| სიმკვრივე (დ.წ.) | 1.505 გ/სმ3 | ||||||||||||||||
| სამმაგი წერტილი | 53.48 K, 90 კპა | ||||||||||||||||
| კრიტიკული წერტილი | 144.41 K, 5.1724 მპა | ||||||||||||||||
| დნობის კუთ. სითბო | 6.51 კჯ/მოლი | ||||||||||||||||
| მოლური თბოტევადობა |
Cp: 31 ჯ/(მოლი·K) Cv: 23 ჯ/(მოლი·K) | ||||||||||||||||
ნაჯერი ორთქლის წნევა
| |||||||||||||||||
| ატომის თვისებები | |||||||||||||||||
| ჟანგვის ხარისხი | −1, 0 | ||||||||||||||||
| ელექტროდული პოტენციალი |
| ||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 3.98 | ||||||||||||||||
| იონიზაციის ენერგია |
| ||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 64 პმ | ||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 135 პმ | ||||||||||||||||
|
ფთორის სპექტრალური ზოლები | |||||||||||||||||
| სხვა თვისებები | |||||||||||||||||
| მესრის სტრუქტურა |
კუბური  | ||||||||||||||||
| თერმული გაფართოება | 0.02591 µმ/(მ·K) | ||||||||||||||||
| მაგნეტიზმი | დიამაგნეტიკი | ||||||||||||||||
| მაგნიტური ამთვისებლობა | −1.2×10−4 სმ3/მოლ | ||||||||||||||||
| CAS ნომერი | 7782-41-4 | ||||||||||||||||
| ისტორია | |||||||||||||||||
| აღმომჩენია | ანდრე მარი ამპერი (1810) | ||||||||||||||||
| პირველი მიმღებია | ანრი მუასანი (1886) | ||||||||||||||||
| ფთორის მთავარი იზოტოპები | |||||||||||||||||
| |||||||||||||||||
| • | |||||||||||||||||
ფთორი ქიმიურად ძალიან ძლიერი აქტიური არალითონია და ყველაზე ძლიერი მჟანგავი. წარმოადგენს ყველაზე მჩატე ელემენტს ჰალოგენებს შორის. ფთორი ნორმალური პირობების დროს ორატომიანი აირია (ფორმულა F2) მკრთალი-მოყვითალო ფერისაა, მკვეთრი სუნით, მოგვაგონებს ოზონს ან ქლორს. ძლიერი საწამლავია.
ისტორია
რედაქტირებაფთორის პირველი ნაერთი — ფლუორიტი (მდნობი შპატი) CaF2 — აღწერილია XV ს. ბოლოს „ფლუორის“ სახელწოდებით. 1771 წ. კარლ ვილჰელმ შეელემ მიიღო ფთორწყალბადმჟავა.
როგორც ფთორწყალბადმჟავის ერთ-ერთი ატომი, ელემენტი ფთორი იწინასწარმეტყველეს 1810 წ., გამოიყო 76 წლის შემდეგ, ანრი მუასანის მიერ, 1886 წელს თხევადი უწყლო წყალბადის ფთორიდის ელექტროლიზის მეთოდით, რომელიც შეიცავდა მჟავე კალიუმის ფთორიდის მინარევს KHF2.
პრაქტიკულად ყველა მკვლევარი, რომლებიც ცდილობდნენ ფთორის აღმოჩენას, ეს სიცოცხლის ან ჯანმრთელობის ფასად უჯდებოდათ.
სახელწოდების წარმომავლობა
რედაქტირებასახელწოდება «ფთორი» (ძვ. ბერძნ. φθόρος — დარღვევა, დაშლა), შემოთავაზებულ იქნა ანდრე მარი ამპერის მიერ 1810 წ., იხმარება ქართულში და სხვა რამდენიმე ენაში; ბევრ ქვეყანაში მიღებულია სახელწოდება, რომელიც წარმოებულია ლათინური «fluorum»-დან (რომელიც მოდის, თავის მხრივ, fluere — «დენა» (ჟონვა) ფთორის ნაერთის, ფლუორიტის თვისების გამო (CaF2). ის დაბლა სწევს მადნის დნობის ტემპერატურა და ზრდის შენადნობის დენადობას).
გავრცელება ბუნებაში
რედაქტირებაფთორის არსებობა ბუნებაში ატომურ პროცენტებში ნაჩვენებია ცხრილში:
| ობიექტი | შემცველობა |
|---|---|
| ნიადაგი | 0,02 |
| მდინარის წყლებში | 0,00002 |
| ოკეანის წყლებში | 0,0001 |
| ადამიანი კბილებში[3] | 0,01 |
ბუნებაში ფთორი მნიშვნელოვნად თავმოყრილია ძირითადად მინერალში ფლუორიტში (CaF2), მასის მიხედვით 51,2 % Ca და 48,8 % F.
ფთორით შედარებით მდიდარია ოსპი და ხახვი.
ფთორის შემცველობა ნიადაგში განპირობებულია ვულკანური აირებით, რადგანაც მათ შემადგენლობაში შედის დიდი რაოდენობით ფთორწყალბადი.
იზოტოპური შემადგენლობა
რედაქტირებაფთორი წარმოადგენს მონოიზოტოპურ ელემენტს, რადგანაც ბუნებაში არსებობს მხოლოდ ერთი სტაბილური ფთორის იზოტოპი 19F. ცნობილია ასევე ფთორის 17 რადიოაქტიური იზოტოპი მასური რიცხვით 14-დან 31-მდე და ერთი ბირთვული იზომერი — 18Fm. ფთორის რადიოაქტიული იზოტოპებიდან ყველაზე სიცოცხლისუნარიანია 18F ნახევარდაშლის პერიოდით 109,771 წუთი, პოზიტრონების მნიშვნელოვანი წყაროა, რომელიც გამოიყენება პოზიტრონ-ემისიურ ტომოგრაფიაში.
ფთორის იზოტოპების ბირთვული თვისებები
რედაქტირება| იზოტოპი | შედარებითი მასა, მ.ა.ე. | ნახევარდაშლის პერიოდი | დაშლის ტიპი | ბირთვული საზ. | ბირთვული მაგნიტური მომენტი |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 წმ | β+-დაშლა 17O-ში | 5/2 | 4.722 |
| 18F | 18,000938 | 1,83 საათი | β+-დაშლა 18O-ში | 1 | |
| 19F | 18,99840322 | სტაბილურია | — | 1/2 | 2.629 |
| 20F | 19,9999813 | 11 წმ | β−-დაშლა 20Ne-ში | 2 | 2.094 |
| 21F | 20,999949 | 4,2 წმ | β−-დაშლა 21Ne-ში | 5/2 | |
| 22F | 22,00300 | 4,23 წმ | β−-დაშლა 22Ne-ში | 4 | |
| 23F | 23,00357 | 2,2 წმ | β−-დაშლა 23Ne-ში | 5/2 |
ბირთვების მაგნიტური თვისებები
რედაქტირებაიზოტოპის 19F ბირთვს აქვს ნახევრადსრული ელექტრონის ზურგის მაგნიტური მომენტების ურთიერთქმედება, ამიტომაც შესაძლებელია ამ ბირთვების გამოყენება ბირთვულ მაგნიტურ რეზონანსში (ბ.მ.რ.)-მოლეკულების საკვლევად. ბ.მ.რ.-ის სპექტრი -19F წარმოადგენს საკმაოდ თვისობრივს ფთორორგანული ნაერთებისათვის.
ელექტრონული აღნაგობა
რედაქტირებაფთორის ატომის ელექტრონული კონფიგურაცია შემდეგია: 1s22s22p5. ფთორის ატომებს ნაერთებში შეუძლიათ გამოავლინონ დაჟანგვის ხარისხი (ვალენტობა) −1. ჟანგვის დადებითი ხარისხი ნაერთებში არ რეალიზირდება, რადგანაც ფთორი წარმოადგენს ყველაზე ელექტროუარყოფით ელემენტს.
ფთორის კვანტოქიმიური ტერმ. — ²P3/2
მოლეკულის აღნაგობა
რედაქტირებამოლეკულური ორბიტალების თეორიის თვალსაზრისით, ორატომიანი ფთორის მოლეკულის აღნაგობა შეიძლება დახასიათებულ იქნას შემდეგი დიაგრამით. მოლეკულაში არის 4 შემაკავშირებელი ორბიტალი და 3 გამაფხვიერებელი. როგორც ჩანს, მოლეკულაში კავშირი რიგი 1 -ის ტოლია.
კრისტალური მესერი
რედაქტირებაატმოსფერული წნევის პირობებში ფთორი ქმნის ორ კრისტალურ მოდიფიკაციას:
- α-ფთორი — არსებობს 45,6 K ტემპერატურაზე დაბლა, კრისტალური მესერი მონოსოლურია, სივრცული ჯგუფი C 2/c, პარამეტრები a = 0,550 ნმ, b = 0,328 ნმ, c = 0,728 ნმ, β = 102,17°, Z = 4 [4][5].
- β-ფთორი — არსებობს ტემპერატურის ინტერვალში 45,6 ÷ 53,53 K, კრისტალური მესერი კუბურია, პარამეტრები a = 0,667 ნმ, Z = 8.
მიღება
რედაქტირებაფთორის მიღების სამრეწველო ხერხი შეიცავს ფლიუორიტული მადნის მოპოვებას და გამდიდრებას, მისი კონცენტრატის გოგირდმჟავიანი დაშლა, გაუწყლოებული HF-ის წარმოქმნით და მისი ელექტროლიტური დაშლით.
ფთორის ლაბორატირიულად მისაღებად გამოიყენებენ ზოგიერთი ნაერთის დაშლას, მაგრამ ისინი არ გვხვდება ბუნებაში საკმაო რაოდენობით და იღებენ თავისუფალი ფთორის მეშვეობით.
ლაბორატორიული მეთოდი
რედაქტირება- ლაბორატორიაში ფთორი შეიძლება მივიღოთ ნაჩვენები დანადგარით. სპილენძის ჭურჭელი 1, ავსებულია შენადნობით KF·3HF ათავსებენ სპილენძის ჭურჭელში 2, რომელსაც ძირში აქვს ნახვრეტი. ჭურჭელ 2-ში ათავსებენ ნიკელის მსხვილ ანოდს. კათოდს ათავსებენ 1 ჭურჭელში. ასე რომ ელექტროლიზის პროცესის დროს გაზისებრი ფთორი გამოიყოფა მილიდან 3, ხოლო წყალბადი მილიდან 4. მნიშვნელოვანი მოთხოვნაა სისტემის ჰერმეტულობა. ამისათვის გამოიყენება კალციუმის ფთორიდის საცობები ტყვიის ოქსიდის (II) და გლიცერინის საპოხით.
- 1986 წელს, ფთორის აღმოჩენის 100 წლისთავისადმი მიძღვნილი კონფერენციის მომზადებისას, კარლ კრისტემ აღმოაჩინა ფთორის მიღების მთლიანად ქიმიური ხერხი ფთორწყალბადის ხსნარში რეაქციის გამოყენებით K2MnF6 და SbF5 150 °C-ის დროს:[6]
- K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2
- 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2
- მიუხედავად იმისა რომ პრაქტიკულად არ გამოიყენება, ის აჩვენებს, რომ ელექტროლიზი აუცილებელი არაა. ამის გარდა, რეაქციის ყველა კომპონენტი შეიძლება მიღებულ იქნას გაზისმაგვარი ფთორის გამოყენების გარეშეც.
ასევე ფთორის ლაბორატორიული მიღებისათვის შეიძლება გამოვიყენოთ კობალტის ფთორიდის (III) გახურებით 300 °С-მდე, ვერცხლის ფთორიდის დაშლით (ძალიან ძვირია) და სხვა ხერხები.
სამრეწველო მეთოდი
რედაქტირებაფთორის სამრეწველო წარმოება ხორციელება KF·3HF მჟავე კალიუმის ფთორიდის შენადნობის ელექტროლიზით (ხშირად ლითიუმის ფთორიდის დამატებით), რომელიც წარმოიქმნება შენადნობის - KF გაჯერებით ფთორწყალბადით შემცველობის 40—41 % HF. ელექტრილიზის პროცესი მიმდინარეობს დაახლოებით 100 °C ტემპერატურის დროს, ფოლადის ელექტროლიზერებში ფოლადის კათოდით და ნახშირის ანოდით.
ფიზიკური თვისებები
რედაქტირებამკრთალი-ყვითელი აირი, მცირე კონცენტრაციისას სუნი გვახსენებს ერთდროულად ოზონს და ქლორს, ძალიან აგრესიულია და მომწამლავია.
ფთორს აქვს ანომალიურად დაბალი დუღილის (დნობის) ტემპერატურა. ეს დაკავშირებულია იმასთან რომ, ფთორს არ გააჩნია d-ქვედონე და არ შეუძლია შექმნას ერთნახევრიანი კავშირები, რითაც განსხვავდება ყველა ჰალოგენისაგან (კავშირების ჯერადობა სხვა ჰალოგენებში მიახლოებით არის 1.1) [7]
ქიმიური თვისებები
რედაქტირებაფთორი ყველაზე აქტიური არალითონია, აქტიურად ურთიერთქმედებს თითქმის ყველა ნივთიერებასთან გარდა, რა თქმა უნდა ფთორიდებთან და იშვიათ გამონაკლისად — ფთოროპლასტებთან, და ბევრ მათგანთან — წვით და ფეთქებით. ფთორის კონტაქტი წყალბადთან იწვევს აალებას და აფეთქებას დაბალ ტემპერატურების დროსაც კი (−252 თარგი:გრადუს ცელსიუსი). ფთორის ატმოსფეროში იწვის წყალი და პლატინაც კი:
- 2F2 + 2H2O → 4HF + O2
რეაქციებში, სადაც ფთორი ფორმალურად წარმოადგენს აღმდგენს, მიეკუთვნება უმაღლესი ფთორიდების დაშლის რეაქციები, მაგალითად:
- XeF8 → XeF6 + F2
- MnF4 → MnF3 + 1/2 F2
ფთორს ასევე შეუძლია დაჟანგოს ჟანგბადი, და წარმოქმნის ჟანგბადის ფთორიდს OF2.
ყველა ნაერთებში ფთორი ავლენს -1 დაჟანგვის ხარისხს (ვალენტობა). იმისათვის რომ ფთორი ავლენდეს დადებით დაჟანგვის ხარისხს საჭიროა ექსიმერული მოლეკულების შექმნა ან სხვა ექსტრემალური პირობები. ამას საჭიროებს ფთორის ატომების ხელოვნურ იონიზაციას.[8]
შენახვა
რედაქტირებაფთორს ინახავენ გაზისებურ მდგომარეობაში (წნევის ქვეშ) და შეკუმშული სახით (თხევადი აზოტით გაციებულს) ნიკელის აპარატებში და მის საფუძველზე არსებული შენადნობებში (მონელ-ლითონი), სპილენძისაგან, ალუმინისა და მისი შენადნობებისაგან, თითბერისაგან, უჟანგავი ფოლადისაგან (ეს შესაძლებელია იმიტომ, რომ ეს ლითონები და შენადნობები იფარებიან ფთორისათვის გადაულახავი ფთორიდების ფენით (აპკით) დამზადებულ ჭურჭელში[9]).
გამოყენება
რედაქტირებაგამოყენება ქიმიაში
რედაქტირებაგაზისებური ფთორი გამოიყენება შემდეგი ნივთიერებების მისაღებად:
- ურანის ჰექსაფთორიდი UF6 из UF4, გამოიყენება ურანის იზოტოპების გასაყოფად ბირთვულ მრეწველობაში.
- ქლორის ტრიფთორიდი ClF3 — მაფთორირებელი აგენტი და სარაკეტო სისტემებში როგორც ძლიერი მჟანგავი.
- გოგირდის ჰექსაფთორიდი SF6 — გაზისებური იზოლატორი ელექტროტექნიკურ მრეწველობაში
- ლითონების ფთორიდები (მაგალითად, W და V), რომლებსაც გააჩნიათ რამდენიმე სასარგებლო თვისებება
- ფრეონები — წარსულში გამოიყენებოდა როგორც მაცივარი აგენტი.
- ტეფლონები — ქიმიურად ინერტული პოლიმერები
- ნატრიუმის ჰექსაფთოროალუმინატი — შემდგომ ალუმინის მისაღებად ელექტროლიზის გამოყენებით
- ფთორის სხვადასხვაგვარი ნაერთები.
სარაკეტო ტექნიკა
რედაქტირებაფთორის ნაერთები გამოიყენება სარაკეტო ტექნიკაში, როგორც სარაკეტო საწვავის მჟანგავი.
გამოყენება მედიცინაში
რედაქტირებაფთორის ნაერთები ფართოდ გამოიყენებიან მედიცინაში, როგორც სისხლის დანამატები.
ბიოლოგიური და ფიზიოლოგიური როლი
რედაქტირებაფთორი წარმოადგენს ორგანიზმის სიცოცხლისუნარიანობისათვის აუცილებელ ელემენტს. ადამიანის ორგანიზმში ფთორი, ძირითადად, შედის კბილის მინანქრის ფთორაპატიტის შემადგენლობაში — Ca5F(PO4)3. არასაკმარისი რაოდენობისას (0,5 მგ/ლ ნაკლები სასმელ წყალში) ან ჭარბი (1 მგ/ლ მეტი) ფთორის მოხმარებისაგან ორგანიზმში შეიძლება განვითარდეს კბილის დაავადებები: კარიესი და ფლუოროზი (მინანქრის დაწინწკლულობა) და ოსტეოსარკომა, შესაბამისად[10].
ფთორის მცირე შემცველობა შლის მინანქარს ფთორის გამორეცხვის ხარჯზე ფთორაპატიტიდან ჰიდროქსოაპატიტის წარმოქმნით, და პირუკუ.
კარიესის პროფილაქტიკისათვის რეკომენდებულია ფთორიანი კბილის პასტები ან ფთორირებული წყლის გამოყენება (1 მგ/ლ-მდე კონცენტრაციით), ან ადგილობრივად 1-2 % ნატრიუმის ფთორიდის ან კალას ფთორიდის ხსნარებთან ერთად გამოყენება. ასეთ ქმედებებს შეუძლიათ კარიესის წარმოქმნის შესაძლებლობის შემცირება 30-50 %-ით.
ფთორის ზღვრული დასაშვები კონცენტრაცია[11] სამრეწველო ფართების ჰაერში ტოლია 0,0005 მგ/ლ.
იხილეთ აგრეთვე
რედაქტირებალიტერატურა
რედაქტირება- რისი ი. გ. ფთორისა და მისი არაორგანული ნაერთების ქიმია. მ. სახქიმგამოცემა, 1966 წ. — 718 ფ.
- ნეკრასოვი ბ. ვ. საერთო ქიმიის საფუძვლები. (მესამე გამოცემა, ტ 1) მ. ქიმია, 1973 г. — 656 ფ.
- L. Pauling, I. Keaveny, and A.B. Robinson, J. Solid State Chem., 1970, 2, p. 225. ინგლ. — ფთორის კრისტალური სტრუქტურა დაწვრილებით
რესურსები ინტერნეტში
რედაქტირება- ფთორი Webelements-ზე
- ფთორი ქიმიური ელემენტების პოპულარულ ბიბლიოთეკაში დაარქივებული 2007-09-30 საიტზე Wayback Machine.
- ინფორმაცია პერფთორანზე დაარქივებული 2009-12-15 საიტზე Wayback Machine.
- სისხლიშემცვლელი პერფთორანი დაარქივებული 2012-01-12 საიტზე Wayback Machine. // Вестник РАН, 1997, ტ 67, N 11, ფ. 998—1013
- ფთორი დაარქივებული 2012-01-12 საიტზე Wayback Machine.
სქოლიო
რედაქტირება- ↑ დოლიძე ვ., ციციშვილი ვ., „ოთხენოვანი ქიმიური ლექსიკონი“, თბ., 2004, გვ. 238
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 10, თბ., 1986. — გვ. 281-282.
- ↑ უმთავრესად ადამიანის კბილების მინანქარში
- ↑ Journal of Solid State Chemistry, Vol. 2, Issue 2, 1970, P. 225-227.
- ↑ J. Chem. Phys. 49, 1902 (1968)
- ↑ გრინვუდი ნ., ერნშო ა. «ელემენტების ქიმია» ტ.2, მ.: ბინომი. ცოდნის ლაბორატორია, 2008 ფ. 147—148, 169 — ფთორის ქიმიური სინთეზი
- ↑ ახმეტოვი ნ. ს. «საერთო და არაორგანული ქიმია».
- ↑ ახალგაზრდა ქიმიკოსის ენციკლოპედიური ლექსიკონი. საშუალო და უფროსი წლოვანთათვის. მ, პედაგოგიკა-პრესს. 1999 წ.
- ↑ ფთორი ქიმიური ელემენტების პოპულარული ბიბლიოთეკა. დაარქივებულია ორიგინალიდან — 2007-09-30. ციტირების თარიღი: 2010-12-04.
- ↑ National Toxicology Program -ის მონაცემებით
- ↑ ფთორიდებისა და ფთოროორგანული ნაერთების სახით
