ტყვია
| ტყვია |
| 82Pb |
| 207.2 |
| 4f14 5d10 6s2 6p2 |
ტყვია[1][2] (ლათ. Plumbum; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეექვსე პერიოდის, მეთოთხმეტე ჯგუფის (მოძველებული კლასიფიკაციით — მეოთხე ჯგუფის მთავარი ქვეჯგუფის, IVა) ქიმიური ელემენტი. მისი ატომური ნომერია — 82, ატომური მასა — 207.2, tდნ — 327.46 °C, tდუღ — 1749 °C, სიმკვრივე — 11.34 გ/სმ3. ძლიერ პლასტიკური, რბილი, მონაცისფრო-მოცისფრო მძიმე ლითონი. ბუნებრივი ტყვია ოთხი სტაბილური იზოტოპის ნარევია (1.40 %), (24.1 %), (22.1 %) და (52.4 %). ტყვიას აქვს ყველაზე დიდი ატომური ნომერი მდგრად ელემენტებს შორის, თუმცა მომდევნო უმძიმეს ელემენტს, ბისმუტს, გააჩნია ნახევრად დაშლის პერიოდი, რომელიც ისეთი ხანგრძლივია, რომ შეიძლება ჩაითვალოს მდგადად. ტყვიის ოთხ მდგრად იზოტოპს გააჩნია 82 პროტონი, "მაგიური რიცხვი" ატომის ბირთვის ღრუბელისებურ მოდელში.
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ზოგადი თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | ძლიერ პლასტიკური, რბილი, მონაცისფრო-მოცისფრო მძიმე ლითონი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(Pb) |
[206.14, 207.94] 207.2±1.1 (დამრგვალებული) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ტყვია პერიოდულ სისტემაში | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჯგუფი | 14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პერიოდი | 6 პერიოდი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბლოკი |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Xe] 4f14 5d10 6s2 6p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 18, 32, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ელემენტის ატომის სქემა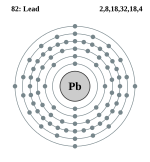 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ფიზიკური თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის ტემპერატურა |
327.46 °C (600.61 K, 621.43 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დუღილის ტემპერატურა |
1749 °C (2022 K, 3180 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 11.34 გ/სმ3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 10.66 გ/სმ3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 4.77 კჯ/მოლი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 179.5 კჯ/მოლი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 26.650 ჯ/(მოლი·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | −4, −2, −1, 0, +1, +2, +3, +4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი |
Pb←Pb2+ −0.126 ვ Pb←Pb4+ 0.80 ვ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 2.33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 175 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 146±5 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 202 პმ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ტყვიას სპექტრალური ზოლები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სხვა თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის სტრუქტურა |
კუბური წახნაგცენტრირებული  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 1190 m/s (ო. ტ.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თერმული გაფართოება | 28.9 µმ/(მ·K) (25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თბოგამტარობა | 35.3 ვტ/(მ·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კუთრი წინაღობა | 208 ნომ·მ (20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნეტიზმი | დიამაგნეტიკი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | −23.0×10−6 სმ3/მოლ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იუნგას მოდული | 16 გპა | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| წანაცვლების მოდული | 5.6 გპა | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დრეკადობის მოდული | 46 გპა | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პუასონის კოეფიციენტი | 0.44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოოსის მეთოდი | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბრინელის მეთოდი | 38–50 მპა | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS ნომერი | 7439-92-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ისტორია | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აღმომჩენია | შუა აღმოსავლეთში (ძვ. წ. 7000-მდე) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ტყვიას მთავარი იზოტოპები | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ტყვია რბილი და ძლიერ პლასტიკური მძიმე ლითონია.[3] მყარ მდგომარეობაში მონაცრისფრო-მოცისფრო ფერი აქვს, გამდნარი ტყვია ელვარებს მოვერცხლისფრო-ქრომის ფრად, ხოლო აირად მდგომარეობაში გადასვლისას იგი ბუნდოვან ნაცრისფერ ნისლად იქცევა. ტყვიას ფართო გამოყენება აქვს სხვადასხვა სფეროში. მისგან მზადდება აკუმულიატორები, ვაზნები, გირები, ტოლჩები და სხვა. გამომდინარე იქიდან, რომ ტყვია რადიაციას არ ატარებს, მისგან მზადდება რადიაციასაწინააღმდეგო ფენები. კალისა და ტყვიის შენადნობი ადვილად ლღვება დაბალ ტემპერატურაზე და გამოიყენება სადენების ერთმანეთზე მისარჩილავად.
ორგანიზმში მოხვედრისას ტყვია მომწამვლელია ცხოველებისთვის. იგი აზიანებს ნერვულ სისტემას და იწვევს უწესრიგობას ტვინში. მეტისმეტად მაღალი კონცენტრაცია იწვევს ასევე სისხლის მიმოქცევის დარღვევას ძუძუმწოვრებში. ისევე როგორც ვერცხლისწყალი, კიდევ ერთი მძიმე ლითონი, ტყვიაც ძლიერი ნეიროტოქსინია და აზიანებს როგორც კან-კუნთოვან, ასევე ძვლოვან ქსოვილებს. ტყვიისგან მოწამვლა დოკუმენტირებულია ჯერ კიდევ ძველი რომის, ძველი საბერძნეთისა და ძველი ჩინეთის პერიოდიდან. მოწამვლა, ჩვეულებრივ, ტყვიის შემცველი საკვებისა და წყლის მიღებით ხდება, მაგრამ შესაძლოა ასევე გრუნტის, მტვერისა და ტყვიაზე დაფუძნებული საღებავის შემთხვევითი შესუნთქვითაც მოხდეს.
რესურსები ინტერნეტში რედაქტირება
- ტყვიის ტოქსიკურობა აშშ-ის ჯანმრთელობისა და სოციალური მომსახურების დეპარტამენტი
- Lead-Free Wheels დაარქივებული 2010-08-30 საიტზე Wayback Machine.
- National Lead Free Wheel Weight Initiative| Waste Minimization|Wastes|US EPA
სქოლიო რედაქტირება
- ↑ დოლიძე ვ., ციციშვილი ვ., „ოთხენოვანი ქიმიური ლექსიკონი“, თბ., 2004, გვ. 196
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 10, თბ., 1986. — გვ. 86-87.
- ↑ ნუმიზმატისა და ბონისტის განმარტებითი ლექსიკონი. დაარქივებულია ორიგინალიდან — 2010-11-29. ციტირების თარიღი: 2010-08-24.




