სპილენძი
| სპილენძი |
| 29Cu |
| 63.546 |
| 3d10 4s1 |
სპილენძი[1][2] (ლათ. Cuprum; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეოთხე პერიოდის, მეთერთმეტე ჯგუფის (მოძველებული კლასიფიკაციით — პირველი ჯგუფის თანაური ქვეჯგუფის, Iბ) ქიმიური ელემენტი. მისი ატომური ნომერია 29, ატომური მასა — 63.546, tდნ — 1084.62 °C, tდუღ — 2562 °C, სიმკვრივე — 8.96 გ/სმ3. სუფთა სპილენძი გარეგნულად მოწითალო-მოვარდისფროა მცირე ოქროსფერი ელვარებით, რბილი და კარგად ჭედადი ლითონია. იგი კარგი ელექტრო- და თბოგამტარიცაა, რის გამოც იგი გამოიყენება ელექტროგამტარებისა (სადენების) და თბოგამტარების დასამზადებლად. გამოიყენება ასევე საშენ მასალად და მრავალი შენადნობის ერთ-ერთი ძირითადი შემადგენელია.
 | ||||||||||||||||||||||||||||||
| ზოგადი თვისებები | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | მოვერცხლისფრო-თეთრი | |||||||||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(Cu) |
63.546±0.003 63.546±0.003 (დამრგვალება) | |||||||||||||||||||||||||||||
| სპილენძი პერიოდულ სისტემაში | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 29 | |||||||||||||||||||||||||||||
| ჯგუფი | 11 | |||||||||||||||||||||||||||||
| პერიოდი | 4 პერიოდი | |||||||||||||||||||||||||||||
| ბლოკი |
| |||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Ar] 3d10 4s1 | |||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 18, 1 | |||||||||||||||||||||||||||||
ელემენტის ატომის სქემა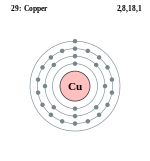 | ||||||||||||||||||||||||||||||
| ფიზიკური თვისებები | ||||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | |||||||||||||||||||||||||||||
| დნობის ტემპერატურა |
1084.62 °C (1357.77 K, 1984.32 °F) | |||||||||||||||||||||||||||||
| დუღილის ტემპერატურა |
2562 °C (2835 K, 4643 °F) | |||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 8.96 გ/სმ3 | |||||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 8.02 გ/სმ3 | |||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 13.26 კჯ/მოლი | |||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 300.4 კჯ/მოლი | |||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 24.440 ჯ/(მოლი·K) | |||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| ||||||||||||||||||||||||||||||
| ატომის თვისებები | ||||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | −2, 0, +1, +2, +3, +4 | |||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი |
| |||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 1.90 | |||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| |||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 128 პმ | |||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 132±4 პმ | |||||||||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 140 პმ | |||||||||||||||||||||||||||||
|
სპილენძის სპექტრალური ზოლები | ||||||||||||||||||||||||||||||
| სხვა თვისებები | ||||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | |||||||||||||||||||||||||||||
| მესრის სტრუქტურა |
კუბური წახნაგცენტრირებული  | |||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 3810 m/s (ო. ტ.) | |||||||||||||||||||||||||||||
| თერმული გაფართოება | 16.5 µმ/(მ·K) (25 °C) | |||||||||||||||||||||||||||||
| თბოგამტარობა | 401 ვტ/(მ·K) | |||||||||||||||||||||||||||||
| კუთრი წინაღობა | 16.78 ნომ·მ (20 °C) | |||||||||||||||||||||||||||||
| მაგნეტიზმი | დიამაგნეტიკი | |||||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | −5.46×10−6 სმ3/მოლ | |||||||||||||||||||||||||||||
| იუნგას მოდული | 110–128 გპა | |||||||||||||||||||||||||||||
| წანაცვლების მოდული | 48 გპა | |||||||||||||||||||||||||||||
| დრეკადობის მოდული | 140 გპა | |||||||||||||||||||||||||||||
| პუასონის კოეფიციენტი | 0.34 | |||||||||||||||||||||||||||||
| მოოსის მეთოდი | 3.0 | |||||||||||||||||||||||||||||
| ვიკერსის მეთოდი | 343–369 მპა | |||||||||||||||||||||||||||||
| ბრინელის მეთოდი | 235–878 მპა | |||||||||||||||||||||||||||||
| CAS ნომერი | 7440-50-8 | |||||||||||||||||||||||||||||
| ისტორია | ||||||||||||||||||||||||||||||
| აღმომჩენია | შუა აღმოსავლეთი (ძვ. წ. 9000) | |||||||||||||||||||||||||||||
| სპილენძის მთავარი იზოტოპები | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| • | ||||||||||||||||||||||||||||||
სპილენძი და მისი შენადნობები უძველესი პერიოდიდან გამოიყენება. ადრე მას მოიპოვებდნენ კუნძულ კვიპროსიდან, საიდანაც მოდის მისი სახელწოდება: Cyprium, „ლითონი კვიპროსიდან“, მოგვიანებით შემოკლდა და მივიღეთ მისი ამჟამინდელი სახელწოდება - Cuprum. შესაძლოა იქ უკვე აღარ იყოს სპილენძის საკმარისი რაოდენობა, რომელიც დააკმაყოფილებდა თანამედრო მაღალ მოთხოვნას ამ ლითონზე.[3] ზოგიერთ ქვეყანას, როგორებიცაა ჩილე და აშშ, ჯერ კიდევ აქვთ სპილენძის მნიშვნელოვანი მარაგი, რომელსაც ისინი დიდი ღია კარიერების საშუალებით მოიპოვებენ.
სპილენძის ნაერთები ხშირად გვხვდება როგორც სპილენძის მარილები Cu2+ იონით, რაც უმეტესად ლურჯ ან მწვანე შეფერილობას აძლევს ფირუზის მსგავს მინერალებს, რომელთაც გამოყენების ხანგრძლივი ისტორია აქვთ პიგმენტების სახით. სპილენძის არქიტექტურული სტრუქტურის საბოლოო კოროზიის შედეგად ვიღებთ დამახასიათებელი მწვანე ფერის პატინას. სპილენძს, როგორც ლითონის ასევე პიგმენტური მარილის სახით, მნიშვნელოვანი გამოყენება აქვს დეკორატიულ ხელოვნებაში.
სპილენძის იონები Cu2+ იხსნება წყალში, სადაც დაბალი კონცენტრაციით ფუნქციონირებენ როგორც ფუნგიციდები, ხეების ჭიებისგან დამცველი და ანტიბაქტერიული ნივთიერებები. გარკვეული რაოდენობით სპილენძის მარილები შესაძლოა შხამიანი აღმოჩნდეს მაღალი ორგანიზმებისთვისაც. მიუხედავად საყოველთაო ტოქსიკურობისა მაღალი კონცენტრაციით, დაბალი კონცენტრაციით Cu2+ იონი არსებითი ბიოგენია ყველა მაღალი ნარგავისა თუ ცხოველის ცხოვრებაში. ცხოველებში და ადამიანში დიდი რაოდენობითაა კანის ქსოვილში, ღვიძლში, კუნთებსა და ძვლებში. იგი მოქმედებს როგორც თანაფაქტორი სხვადასხვა ფერმენტებსა და სპილენძზე დაფუძნებულ პიგმენტებში.
რესურსები ინტერნეტში
რედაქტირება- სპილენძის რესურების გვერდი შეიცავს 12 ფაილს PDF ფორმატში, რომლებიც ასახავს სხვადასხვა სახის სპილენძის ფიზიკურ (მატერიალურ) თვისებებს და ასევე მისი წარმოების სახელმძღვანელოებს.
- სპილენძის განვითარების ასოციაცია გაფართოებული საიტი სპილენძის თვისებებსა და გამოყენებაზე.
- The Third Millennium Online - სპილენძი დაარქივებული 2010-09-17 საიტზე Wayback Machine.
- WebElements - სპილენძი
სქოლიო
რედაქტირება- ↑ დოლიძე ვ., ციციშვილი ვ., „ოთხენოვანი ქიმიური ლექსიკონი“, თბ., 2004, გვ. 131
- ↑ ქართული საბჭოთა ენციკლოპედია, ტ. 9, თბ., 1985. — გვ. 515-516.
- ↑ ლითონების შეზღუდული მიწოდება დედამიწაზე შეშფოთებას იწვევს. ციტირების თარიღი: 2008-03-16.
