წყალბადის პეროქსიდი
წყალბადის პეროქსიდი, H2O2 — პეროქსიდების უმარტივესი წარმომადგენელი, „ლითონის“ გემოს მქონე უფერო სითხე, შეუზღუდავად იხსნება წყალსა და ეთერში. წყლის კონცენტრირებული გამხსნელები ფეთქებადია. წყალბადის პეროქსიდი კარგ გამხსნელს წარმოადგენს. წყლიდან გამოიყოფა არამდგრადი H2O2•2H2O კრისტალოჰიდრატის სახით.
| წყალბადის პეროქსიდი | |
 | |
 | |
| ზოგადი | |
|---|---|
| სისტემური სახელწოდება | წყალბადის პეროქსიდი |
| ქიმიური ფორმულა | H2O2 |
| მოლური მასა | 34,01 გ/მოლი |
| ფიზიკური თვისებები | |
| მდგომარეობა (სტ. პირ.) | თხევადი |
| სიმკვრივე | 1.4 გ/სმ³ |
| კინემატიკური სიბლანტე (სტ. პირ.) | 1,245 სმ²/წ (20 °C-ზე) |
| თერმული თვისებები | |
| დნობის ტემპერატურა | −0,432 °C |
| დუღილის ტემპერატურა | 150,2 °C |
| წარმოქმნის ენტალპია (სტ. პირ.) | -136.11 კჯ/მოლი |
| ქიმიური თვისებები | |
| pKa | 11.65 |
| კლასიფიკაცია | |
| CAS | 7722-84-1 |
| SMILES |
|
წყალბადის პეროქსიდის მოლეკულას ამგვარი აგებულება აქვს:
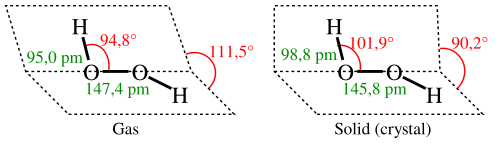
არასიმეტრიულობის გამო მოლეკულა H2O2 ძლიერ პოლარულია (μ = 0,7×10−29 კ·მ). წყალბადის თხევადი პეროქსიდის შედარებითად მაღალი სიბლანტე გამოწვეულია წყალბადური ბმების განვითარებული სისტემით. იქიდან გამომდინარე, რომ ჟანგბადის ატომებს აქვთ გაუნაწილებელი ელექტრონული წყვილები, H2O2 მოლეკულას აგრეთვე შეუძლია დონორულ-აქცეპტორული ბმების წარმოქმნა.
ხსნარი დაბალპროცენტიანი წყალბადის პეროქსიდის შემცველობით არ არის სახიფათო, მაგრამ როდესაც შემცველობა 70%-ს აჭარბებს შესაძლებელი ხდება მისგან ფეთქებადი ნივთიერების მიღება. 2005 წელს ლონდონის ერთ-ერთ მეტროში გამოიყენეს კონცენტრირებული წყალბადის პეროქსიდი. აფეთქებას 52 ადამიანი ემსხვერპლა.[1]
ლიტერატურა
რედაქტირება- Ахметов Н. С., Общая и неорганическая химия, М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И., Общая и неорганическая химия, М.: Химия, 1994.