პოლარული ნივთიერებები
პოლარული ნივთიერება — ქიმიაში არის ნივთიერება, რომლის მოლეკულებს გააჩნიათ ელექტრონული დიპოლური მომენტი. პოლარული ნივთიერებებისთვის, არაპოლარულ ნივთიერებებთან შედარებით, დამახასიათებელია მაღალი ფარდობითი დიელექტრიკული შეღწევადობა (თხევად ფაზაში 10-ზე მეტი), მაღალი დუღილისა და დნობის ტემპერატურა.
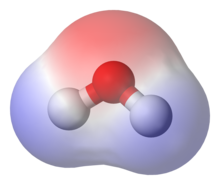
პოლარული მოლეკულები ურთიერთქმედებენ დიპოლ – დიპოლური მოლეკულათშორისი ძალების და წყალბადური ბმების საშუალებით. პოლარობას საფუძვლად უდევს უამრავი ფიზიკური თვისება, მათ შორის ზედაპირული დაძაბულობა, ხსნადობა, დნობის და დუღილის ტემპერატურები.
პოლარული გამხსნელებში ყველაზე უკეთ იხსნებიან პოლარული ნივთიერებები, მათ ასევე გააჩნიათ იონების სოლვატაციის უნარი. პოლარული გამხსნელების მაგალითებია წყალი, ამიაკი, სპირტები, და სხვა ნივთიერებები.
ბმების პოლარობა
რედაქტირებაიმის გამო, რომ ელექტრონებს აქვთ უარყოფითი მუხტი, ელექტრონების არათანაბარი გადანაწილება ბმის შიგნით იწვევს ელექტრული დიპოლის წარმოქმნას: ამიტომაც დადებითი და უარყოფითი ელექტრული მუხტები განცალკევდება. ასეთ დიპოლებში განცალკევებული მუხტები ჩვეულებრივ უფრო მცირეა, ვიდრე ფუნდამენტური მუხტი, ამიტომაც ასეთ მუხტებს უწოდებენ ნაწილობრივ მუხტებს, აღინიშნებიან δ + (დელტა პლუსით) და δ− (დელტა მინუსით). ეს სიმბოლოები შემოიღეს 1926 წელს სერ კრისტოფერ ინგოლდმა და დოქტორმა ედიტ ჰილდა ინგოოლდმა.[1][2]
სუსტი ელექტრული გადახრა შესაძლებელია თუნდაც არაპოლარული სითხეებისთვისაც.[3]
კლასიფიკაცია
რედაქტირებაბმების პოლარობა, როგორც წესი, იყოფა სამ ჯგუფად, რომლებიც დამყარებული არის ელექტროუარყოფითობის განსხვავებაზე, ბმის მქონე ატომებს შორის. პაულინგის სკალის მიხედვით:
- არაპოლარული ბმები, ძირითადად მაშინ ჩნდება, როდესაც ელექტროუარყოფითობის სხვაობა ორ ატომს შორის 0,5 – ზე ნაკლებია.
- პოლარული ბმები, ძირითადად ჩნდება როდესაც ელექტროუარყოფითობა ორ ატომს შორის მერყეობს დაახლოებით 0,5-სა და 2.0-ს შორის.
- იონური ბმები ზოგადად ჩნდება, როდესაც ელექტროუარყოფითობის სხვაობა ორ ატომს შორის 2.0-ს აღემატება.
პაულინგმა ეს კლასიფიკაციის სქემა დაფუძნა ბმის ნაწილობრივ იონურ თვისებაზე. მისი შეფასებით, 1.7-ი სხვაობა შეესაბამება 50% იონურ ბმას, ასე რომ უფრო დიდი სხვაობა შეესაბამება ბმას, რომელიც უფრო მეტად იონიურია.[4]
როგორც კვანტურ-მექანიკური აღწერილობით, პაულინგმა გამოიყენა პოლარული მოლეკულის AB- ისთვის ტალღური ფუნქცია, რაც არის კოვალენტური და იონური მოლეკულების ტალღური ფუნქციების ხაზოვანი კომბინაცია: ψ = aψ(A:B) + bψ(A+B−).
კოვალენტური და იონური თვისებები დამოკიდებულია კვადრატული კოეფიციენტების მნიშვნელობებზე a2 და b2-ზე.[5]
პოლარობის პროგნოზირება
რედაქტირებანივთიერება შედგენილობის მიხედვით შესაძლებელია იმის პროგნოზირება ნივთიერება პოლარულია თუ არაპოლარული. ცხრილში მოცემულია მაგალითები:
| ფორმულა | აღწერა | მაგალითი | სახელი | |
|---|---|---|---|---|
| პოლარული | AB | წრივი მოლეკულები | CO | ნახშირბადის მონოქსიდი |
| HAx | მოლეკულები ერთი H-ით | HF | წყალბადის ფთორიდი | |
| AxOH | მოლეკულები „OH“ დაბოლოებით | C2H5OH | ეთანოლი | |
| OxAy | მოლეკულები „O“ დაბოლოებით | H2O | წყალი | |
| NxAy | მოლეკულები „N“ დაბოლოებით | NH3 | ამიაკი | |
| არაპოლარული | A2 | დიატომური მოლეკულები ერთი და იმავე ელემენტით | O2 | ჟანგბადი |
| CxAy | უმეტესი ნახშირბადის ნაერთები | CO2 | ნახშირორჟანგი |
რესურსები ინტერნეტში
რედაქტირებასქოლიო
რედაქტირება- ↑ Jensen, William B. (2009). „The Origin of the "Delta" Symbol for Fractional Charges“. J. Chem. Educ. 86: 545. Bibcode:2009JChEd..86..545J. doi:10.1021/ed086p545.
- ↑ Ingold, C. K.; Ingold, E. H. (1926). „The Nature of the Alternating Effect in Carbon Chains. Part V. A Discussion of Aromatic Substitution with Special Reference to Respective Roles of Polar and Nonpolar Dissociation; and a Further Study of the Relative Directive Efficiencies of Oxygen and Nitrogen“. J. Chem. Soc.: 1310–1328. doi:10.1039/jr9262901310.
- ↑ Ziaei-Moayyed, Maryam; Goodman, Edward; Williams, Peter (2000-11-01). „Electrical Deflection of Polar Liquid Streams: A Misunderstood Demonstration“. Journal of Chemical Education. 77 (11): 1520. Bibcode:2000JChEd..77.1520Z. doi:10.1021/ed077p1520. ISSN 0021-9584.
- ↑ Pauling, L. (1960). The Nature of the Chemical Bond, 3rd, Oxford University Press, გვ. 98–100. ISBN 0801403332.
- ↑ Pauling, L. (1960). The Nature of the Chemical Bond, 3rd, Oxford University Press, გვ. 66. ISBN 0801403332.