ცილის სტრუქტურა
ცილები ორგანული ნივთიერებების უმნიშვნელოვანესი ჯგუფია, რომელსაც ორგანიზმში მრავალგვარი ფუნქციები აკისრია. ცილების განსაკუთრებულობა მათი სპეციფიკურობიდან გამომდინარეობს.
ცილა არის პოლიმერი, რომლის მონომერი ამინომჟავაა, ცილის შენებაში 20 სხვადასხვა ამინომჟავა იღებს მონაწილეობას. ყველა მათგანი ამინო და კარბოქსილის ჯგუფს შეიცავს. ისინი მხოლოდ რადიკალებით განსხვავდებიან. ზოგი ამინომჟავას რადიკალი ჰიდროფობურია, ზოგის - ჰიდროფილური, ზოგის - დადებითად დამუხტული, ზოგის კი - უარყოფითად.
ცილის სტრუქტურები რედაქტირება
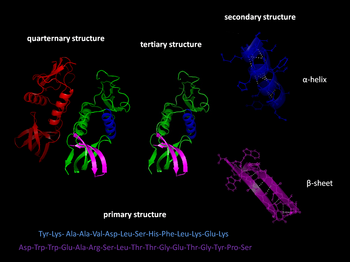
პირველადი სტრუქტურა რედაქტირება
ამინომჟავები ერთმანეთს კოვალენტური, ეგრეთ წოდებული პეპტიდური (ამიდური ბმებით) ბმებით უკავშირდებიან და წარმოქმნიან პოლიპეპტიდის ძაფისებრ სტრუქტურას, რომელსაც ცილის პირველადი სტრუქტურა ეწოდება.
მეორეული სტრუქტურა რედაქტირება
ცილების უმეტესობას პოლიპეპტიდურ ჯაჭვზე აქვს განმეორებითად დახვეული ან ჩაკეცილი ფორმის სეგმენტი, რომელიც ცილის საბოლოო კონფორმაციას განაპირობებს. პოლიპეპტიდური ჯაჭვი არის ამინომჟავების ჯაჭვი რომელიც პეპტიდური ბმებითაა დაკავშირებული ერთმანეთთან. პეპტიდური ბმა არის ისეთი ქიმიური ბმა, რომელიც წარმოიქმნება ერთ-ერთი ამინომჟავის კარბოქსილის ჯგუფის (-COOH) სხვა ამინომჟავის ჯგუფთან დაკავშირებით.
ეს ხვეულები და ნაკეცები, რომელთა ერთობლიობასაც მეორეული სტრუქტურა ეწოდება, არის იმ წყალბადური ბმების შედეგი, რომლებიც წარმოიქმნება პოლიპეპტიდური ჩონჩხის განმეორებით. ჩონჩხის შემადგენლობაში მყოფი ჟანგბადისა და აზოტის ატომები ნაწილობრივ უარყოფით მუხტს ატარებს.
აზოტის ატომთან დაკავშირებულ, სუსტი დადებითი მუხტის მქონე წყალბადს, თვისობა ახასიათებს მეზობელი პეპტიდური ბმის შემადგენელ ჟანგბადის ატომთან. ცალ-ცალკე ეს წყალბადური ბმები სუსტია, მაგრამ რადგან ისინი მრავალჯერადად მეორდება პოლიპეპტიდური ჯაჭვის შედარებით გრძელ რეგიონებზე, ცილის მოლეკულის ამ ნაწილის გარკვეული ფორმის შენარჩუნებას განაპირობებენ. ერთ-ერთი ასეთი მეორეული სტრუქტურა α სპირალია, ნაზი სტრუქტურა, რომელსაც იკავებს ყოველ მეოთხე ამინომჟავას შორის არსებული წყალბადური ბმები. ზოგიერთ ბოჭკოვან ცილას, მაგალითად თმის სტრუქტურულ ცილას – α კერატინის, სიგრძის უმეტეს ნაწილზე ორი α სპირალი აქვს. მეორეული სტრუქტურის ძირითადი ტიპია β ჩაკეცილი ფენები. ამ სტრუქტურის შემთხვევაში გვერდი-გვერდ განლაგებული პოლიპეპტიდური ჯაჭვის ორ ან მეტ რეგიონს აერთებს ორ პარალელურ პოლიპეპტიდური ჩონჩხს შორის არსებული წყალბადური ბმები.
ჩაკეცილი ფილები მრავალი გლობალური ცილის, მაგალითად, ტრანსთირეტინის, ცენტრალურ ნაწილს შეადგენს და აკონტროლებს ზოგ ბოჭკოვან ცილას, ობობას ქსელის ძაფის ცილის ჩათვლით. მრავალრიცხოვანი წყალბადური ბმების ერთობლიობა ობობას ქსელის ძაფს მეტ სიმტკიცეს ანიჭებს, ვიდრე იგივე წონის ლითონის ნაჭერს ახასიათებს.
მესამეული სტრუქტურა რედაქტირება
სპირალი ძაფის გორგალივით იხვევა და ცილის მესამეულ სტრუქტურას წარმოქმნის. მეორეული სტრუქტურის თვისებები ცილის მესამეულ სტრუქტურას განაპირობებს, მესამეული სტრუქტურა პოლიპეპტიდის სრული ფორმაა, რომელსაც სხვადასხვა ამინომჟავების გვერდით ჯაჭვებს შორის არსებული კავშირი განაპირობებს, უფრო, ვიდრე ჩონჩხის კომპონენტებს შორის კავშირი. ერთი ტიპის კავშირის სახელი, რომელიც მესამეულ სტრუქტურაში მონაწილეობს შეცდომაში შემყვანია. ეს ჰიდროფობული (არაპოლარული) გვერდითი ჯაჭვების მქონე ამინომჟავები, როგორც წესი წყალთან კონტაქტის გარეთ მყოფ ცილის ცენტრის კლასტერში ბოლოვდება.
მეოთხეული სტრუქტურა რედაქტირება
ზოგი ცილა ორი ან მეტი პოლიპეპტიდური ჯაჭვისგან შედგება, რომლებიც ერთ ფუნქციონალურ მოლეკულას ქმნიან. მეოთხეული სტრუქტურა ამ პოლიპეპტიდური სუბერთეულების გაერთიანების შედეგია და ცილის საბოლოო სტრუქტურას წარმოადგენს. მეოთხეული სტრუქტურის ჰორმონები ადამიანის სხეულში შემდეგია: ჰემოგლობინი, ინსულინი, გლუკაგონი
ლიტერატურა რედაქტირება
- ნილ კემპბელი, ჯეინ ბ. რისი, „ბიოლოგია“, VII გამოცემა, გვ. 102-103, თბ., 2009 წელი.