ფოსფორმჟავა
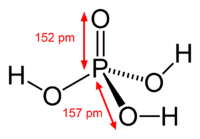
ფოსფორმჟავა ან ორთოფოსფორფმჟავა — სუსტი არაორგანული მჟავა, ქიმიური ფორმულით H3PO4. ნორმალურ პირობებში წარმოადგენს უფერო ჰიგროსკოპულ კრისტალებს. კონცენტრირებული, ანუ 85%-იანი ფოსფორმჟავა არის გამჭირვალე ბლანტი სითხე. 213 °C-ზე უფრო მაღალ ტემპერატურაზე იგი გადაიქცევა პიროფოსფორულ მჟავად:
| ფოსფორმჟავა | |
 | |
 | |
| ზოგადი | |
|---|---|
| სისტემური სახელწოდება | ფოსფორმჟავა ორთოფოსფორმჟავა |
| ქიმიური ფორმულა | H3PO4 |
| მოლური მასა | 97.994 გ/მოლი |
| ფიზიკური თვისებები | |
| მდგომარეობა (სტ. პირ.) | უფერო, თხევადი ბლანტი ნივთიერება |
| სიმკვრივე | 1.6845 (85%-იანი)[1] გ/სმ³ |
| თერმული თვისებები | |
| დნობის ტემპერატურა | 40–42.4 [2] °C |
| დუღილის ტემპერატურა | 212 [3] °C |
| NFPA 704 | |
- H4P2O7 + H2O ⇌ 2H3PO4
წარმოება
რედაქტირებაფოსფორმჟავას წარმოების ორი ინდუსტრიული ხერხი არსებობს..[4] პირველია ფოსფატოვან მარილზე ძლიერი მჟავის მოქმედება, მაგალითად გოგირდმჟავასა და კალციუმის ჰიდროქსიაპატიტის რეაქციისას, ფოსფორმჟავას მჟავურ ნაშთს ანაცვლებს გოგირდმჟავას ნაშთი, მიიღება ფოსფორმჟავა კალციუმის სულფატი და წყალი:[5]
მეორე ხერხით ფოსფორმჟავას იღებენ ფოსფორის პენტოქსიდისა და წყლის ურთიერთქმედებით:
სქოლიო
რედაქტირება- ↑ Christensen, J. H. and Reed, R. B. (1955). „Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C“. Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ Haynes, p. 4.80
- ↑ http://www.chemspider.com/Chemical-Structure.979.html
- ↑ Becker, Pierre. (1988) Phosphates and phosphoric acid. New York: Marcel Dekker. ISBN 978-0824717124.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements, 2nd, Butterworth-Heinemann, გვ. 520–522. ISBN 0-08-037941-9.
