აზოტის ოქსიდი
აზოტის ოქსიდად შეიძლება მოხსენიებული იქნას ყველა ბინარული ნაერთი, რომელიც აზოტსა და ჟანგბადს შეიცავს:
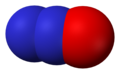
- აზოტოვანი ოქსიდი, აგრეთვე ცნობილი როგორც აზოტის მონოქსიდი, NO და აზოტის (II) ოქსიდი.
- აზოტის დიოქსიდი (NO2), აზოტის (IV) ოქსიდი.
- დიაზოტის მონოქსიდი (N2O), აზოტის (−I,III) ოქსიდი
- ნიტროზილაზიდი (N4O), აზოტის (−I,0,I,II) ოქსიდი
- ოქსატეტრაზოლი (N4O)
- დიაზოტის ტრიოქსიდი (N2O3), აზოტის(II,IV) ოქსიდი
- დიაზოტის ტეტროქსიდი (N2O4), აზოტის(IV) ოქსიდი
- დიაზოტის პენტოქსიდი (N2O5), აზოტის(V) ოქსიდი
- ტრინიტრამიდი (N(NO2)3 ან (N4O6), აზოტის(0,IV) ოქსიდი
- ნიტრიტი (NO2)
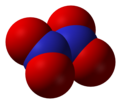
- ნიტრატი (NO3)
- ნიტრონიუმის იონი (NO2+)
- ნიტროზონიუმის იონი (NO+)
- პეროქსინიტრიტის იონი (ONO2-)
ნაერთები NO და NO2 რადიკალებს წარმოადგენენ.
დამატებით, არსებობს აზოტის ოქსიდების რამდენიმე ანიონიც. მათ შორის ყველაზე სტაბილური ნიტრატის ანიონია:
- ნიტრატი (NO3−), ტრიოქსონიტრატის(V) იონი.
აზოტის სხვა ოქსოანიონებია ნიტრიტი, პეროქსინიტრიტი, ტრიოქსოდინიტრატი (ჰიპონიტრატი) და ნიტროქსილატი.
ატმოსფეროს ქიმიაში, ჰაერის დაბინძურებაში და მსგავს თემებში ხსენებისას აზოტის ოქსიდი ძირითადად NOx (NO და NO2)-ად იგულისხმება.[1]
ოთახის ტემპერატურაზე მხოლოდ პირველი სამი ნაერთის გამოყოფაა შესაძლებელი. N2O3, N2O4 და N2O5 ოთახის ტემპერატურაზე მომენტალურად იშლებიან, NO3, N4O და N(NO2)3 კი ძალიან აქტიურები არიან.
ოთახის ტემპერატურაზე N2O სტაბილური და არააქტიურია მაშინ, როცა NO და NO2-ც აქტიურები არიან, მაგრამ სტაბილურებიც.
-
აზოტოვანი ოქსიდი, NO -
აზოტის დიოქსიდი, NO2 -
აზოტის ქვეოქსიდი, N2O -
დიაზოტის ტრიოქსიდი, N2O3 -
დიაზოტის ტეტროქსიდი, N2O4 -
დიაზოტის პენტოქსიდი, N2O5 -
ტრინიტრამიდი, N(NO2)3
NOx
რედაქტირებასახელ NOx-ის (ხშირად იწერება როგორც NOx) ხსენებისას როგორც წესი იგულისხმება NO და NO2. ისინი შიდაწვის ძრავებში წარმოიქმნებიან. ეს ორი ატმოსფეროში კვალის სახით არსებული ნაერთი ნაერთი ძალიან დიდი მნიშვნელობის მქონეებია. დღის განმავლობაში ტროფოსფეროში არსებული NO რეაქციაში შედის ნახევრად-დაჟანგულ ორგანულ ნაერთებთან )ან პეროქსილის რადიკალთან და წარმოქმნის NO2-ს, რომელიც დღის სინათლით ფოტოდისოცირდება და წარმოქმნის NO-ს:
- NO + CH3O2 → NO2 + CH3O
- NO2 + მზის სინათლე → NO + O
მეორე რეაქციისას წარმოშობილი ჟანგბადის ატომი წარმოქმნის ოზონს. ტროპოსფერული ოზონის მთავარ წყაროს სწორედ ეს რეაქციები წარმოადგენენ. იმ ნახევრად-დაჟანგული ორგანული ნაერთს, რომელიც NO2-თან რეაქციაში შედიან, წარმოადგენს მაგალითად CH3O2, სხვა მრავალთან ერთად.
ამ რეაქციების სისწრაფე საკმაოდ დიდია, ამიტომ NO-სა და NO2-ს კონცენტრაცია თითქმის იგივე რჩება. ამ ციკლის გამო ლოგიკურია ეს ორი ნივთიერება ერთ ჯგუფს მივაკუთვნოთ (ამიტომაც ეძახიან მათ NOx</sub-ებს).
იმაზე დამატებით, რომ NOx ტროპოსფერული ოზონის მთავარ წყაროს წარმოადგენს, ადამიანის ჯანმრთელობისათვის ის თვითონაც საკმაოდ საშიშია.
წყალთან შეხებისას NOx ები აზოტმჟავას წარმოქმნიან, რომელიც მიწაში მოხვედრისას ნიტრატებს წარმოქმნის, რომელიც ერთ-ერთი ყველაზე სასარგებლო სასუქია მცენარეებისათვის.
წარმოებულები
რედაქტირებაამ ოქსიდების ბევრი დაჟანგული (კათიონური) და აღდგენილი (ანიონური) სახით წარმოქმნილი ნაერთები არსებობს: ნიტრიტები (NO2-), ნიტრიტები (NO3-), ნიტრონიუმის იონი (NO2+) და ნიტროზონიუმის იონი (NO+):
- NO2+ + e− → NO2
- NO2 + e− → NO2-
მიღება
რედაქტირებააზოტის ქვეოქსიდის (N2O) მიღების ძირითად ლაბორატორიულ ხერხს წარმოადგენს ამონიუმის ნიტრატის გახურება:
- NH4NO3 → N2(აირი) + 2H2O
დიაზოტის ტრიოქსიდი (N2O3) მიიღება ნიტრიტებზე, მაგალითად ნატრიუმის ნიტრიტზე გოგირდმჟავის მოქმედებით, მისი პროდუქტების გაციებით -20 გრადუსამდე
- 2NaNO2 + H2SO4 → Na2SO4 + H2O + N2O3(აირი, რომელიც იშლება ოთახის ტემპერატურაზეც კი)
დიაზოტის პენტოქსიდი მიიღება U-ს ფორმის მილში ტეტრაფოსფორის დეკაოქსიდისა და აზოტმჟავის პროდუქტების გაციებით. უნდა ვერიდოთ ნემსისებური კრისტალების წარმოქმნას. რეაქციისა და კრისტალიზაციის არეში დაუშვებელია ორგანული ნაერთების აღმოჩენა(ნაერთი აფეთქებით რეაგირებს ორგანიკასთან).
- P4O10 + 12 HNO3 → 4 H3PO4 + 6 N2O5
ტრინიტრამიდი მიიღება ძალიან დაბალი (-100 – -80°C) ტემპერატურისას ნატრიუმის ტეტრაფთორბორიდის ურთიერთქმედებით დინიტრამიდის მარილებთან.
იხილეთ ასევე
რედაქტირება- აზოტის ოქსიდების სენსორი
- გოგირდის ნიტრიდები, რომლებიც აზოტის ოქსიდების მიმართ იზოელექტრულები არიან.
სქოლიო
რედაქტირება- ↑ Seinfeld, John H.; Pandis, Spyros N. (1997), Atmospheric Chemistry and Physics: From Air Pollution to Climate Change, Wiley-Interscience, ISBN 0-471-17816-0