ქსენონის ტეტროქსიდი
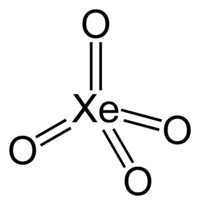
ქსენონის ტეტროქსიდი — არაორგანული ნაერთი. შედგება ქსენონისა და ჟანგბადისგან. მისი ქიმიური ფორმულაა . არის ყვითელი, კრისტალური, მყარი ნივთიერება, რომელიც სტაბილურია −35.9 °C-ის ქვემოთ. ამ ტემპერატურის ზემოთ ქსენონის ტეტროქსიდი ფეთქდება და გამოიყოფა ქსენონი და ჟანგბადი (O2).[2][3].
| ქსენონის ტეტროქსიდი | |
 | |
 | |
| ზოგადი | |
|---|---|
| სისტემური სახელწოდება | ქსენონის ტეტრაოქსიდი; ქსენონ(VIII) ოქსიდი |
| ტრადიციული სახელწოდება | ქსენონის ტეტროქსიდი |
| ქიმიური ფორმულა | |
| მოლური მასა | 195.29 გ/მოლი |
| თერმული თვისებები | |
| დნობის ტემპერატურა | −35.9 °C |
| დუღილის ტემპერატურა | 0[1] °C |
| სტრუქტურა | |
| კოორდინაციული გეომეტრია | ტეტრაედრული |
| დიპოლური მომენტი | 0 დ |
ნაერთში ქსენონის რვავე ვალენტური ელექტრონი მონაწილეობს და მისი ჟანგვის რიცხვი არის +8. ჟანგბადი ერთადერთი ელემენტია, რომელსაც შეუძლია ქსენონი მის უმაღლეს ჟანგვის მდგომარეობამდე დაჟანგოს. მაგალითისთვის, ფთორს ქსენონის დაჟანგვა მხოლოდ ქსენონის ჰექსაფტორიდამდე (XeF6; +6 ჟანგვის ხარისხამდე) შეუძლია.
რეაქციები
რედაქტირება−35.9 °C-ზე ზევით ქსენონის ტეტროქსიდი ხდება ფეთქებადი ნივთიერება. აფეთქებისას გამოიყოფა აირადი ქსენონი და ჟანგბადი:
- XeO4 → Xe + 2 O2
წყალში გახსნისას ქსენონის ტეტროქსიდი წარმოქმნის პერსენატის მჟავას, ტუტე ლითონებთად კი — პერქსენატის მარილებს:
- XeO4 + 2 H2O → H4XeO6
- XeO4 + 4 NaOH → Na4XeO6 + 2 H2O
ქსენონის ტეტროქსიდი რეაქციაში შედის ქსენონის ჰექსაფტორიდთან და მიიღება ქსენონის ჟანგბადფთორიდები:
- XeO4 + XeF6 → XeOF4 + XeO3F2
- XeO4 + 2XeF6 → XeO2F4 + 2 XeOF4
სინთეზი
რედაქტირებაყველა სახის სინთეზი იწყება პერქსენატებიდან:
- 2 HXeO4− + 2 OH− → XeO64− + Xe + O2 + 2 H2O
სხვა ხერხით დაჟანგვა შესაძლებელია პერქსენატის ოზონაციით ხსნარში:
- HXeO4− + O3 + 3 OH− → XeO64− + O2 + 2 H2O
ბარიუმის პერქსენატი რეაქციაში შედის გოგირდმჟავასთან და მიიღება ბერქსენატის მჟავა, მჟავა რადგან არასტაბილურია განიცდის დეჰიდრატაციას დამიიღება ქსენონის ტეტროქსიდი და გამოიყოფა წყალი.[4]
- Ba2XeO6 + 2 H2SO4 → 2 BaSO4 + H4XeO6
- H4XeO6 → 2 H2O + XeO4
იხილეთ აგრეთვე
რედაქტირებასქოლიო
რედაქტირება- ↑ Lide, David R. (1998). Handbook of Chemistry and Physics (87 ed.). Boca Raton, Florida: CRC Press. p. 494. ISBN 0-8493-0594-2.
- ↑ H.Selig , J. G. Malm , H. H. Claassen , C. L. Chernick , J. L. Huston (1964). „Xenon tetroxide -Preparation + Some Properties“. Science. 143 (3612): 1322–3. doi:10.1126/science.143.3612.1322. JSTOR 1713238. PMID 17799234.CS1-ის მხარდაჭერა: მრავალი სახელი: ავტორების სია (link)
- ↑ J. L. Huston; M. H. Studier; E.N. Sloth (1964). „Xenon tetroxide - Mass Spectrum“. Science. 143 (3611): 1162–3. doi:10.1126/science.143.3611.1161-a. JSTOR 1712675. PMID 17833897.
- ↑ (1997) Chemistry of the Elements, 2nd, Elsevier, გვ. 901. ISBN 9780080501093.
