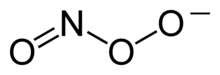
პეროქსინიტრიტის იონი
პეროქსინიტრიტი (ხანდახან მოიხსენიება, როგორც პეროქსონიტრიტი) — იონი, რომლის ფორმულაა ONOO−. წარმოადგენს ნიტრატის, NO3- არასტაბილურ სტრუქტურულ იზომერს. მიუხედავად იმისა, რომ მისი შესაბამისი მჟავა არასტაბილური ნაერთია, პეროქსინიტრიტი საკმაოდ სტაბილურია ტუტე ხსნარებში.[1][2] მიიღება წყალბადის პეროქსიდის ურთიერთქმედებით ნიტრიტებთან:

- H2O2 + NO2 → ONOO− + H2O
პეროქსინიტრიტი მჟანგავ და მანიტრირებელ ნივთიერებას წარმოადგენს. მისი მჟანგავი თვისებების გამო პეროქსინიტრიტს შეუძლია დააზიანოს მოლეკულების საკმაოდ დიდი ნაირსახეობები უჯრედებში, (მაგალითად დნმ და პროტეინები. ცოცხალ ორგანიზმებში პეროქსინიტრიტების წარმოქმნა აღწერილია როგორც სუპეროქსიდის თავისუფალი რადიკალის აზოტოვან ოქსიდთან:[3][4]
- •O2− + •NO → ONO2−
ამ ორი თავისუფალი რადიკალის შეერთებით ვიღებთ პეროქსინიტრიტს. მოლეკულას, რომელიც არ წარმოადგენს თავისუფალ რადიკალს. ის ძლიერი მჟანგავია.
ლაბორატორიაში პეროქსინიტრიტის ხსნარის მიღება შესაძლებელია მაღალი მჟავიანობის მქონე წყალბადის პეროქსიდის ზემოქმედებით ნატრიუმის ნიტრიტზე მისი შემდგომი ნატრიუმის ტუტით ნეიტრალიზაციით. მისი კონცენტრაციის მაჩვენებელია სინათლის შთანთქმა 302 ნმ დიაპაზონში(pH 12, ε302 = 1670 M−1 cm−1).[5]
როგორც ნუკლეოფილი რედაქტირება
ONOO− ურთიერთქმედებს ნუკლეოფილურად ნახშირბადის დიოქსიდთან. ცოცხალ ორგანიზმებში ნახშირბადის დიოქსიდი დაახლოებით 1მმ-ს წარმოადგენს და მისი რეაქცია ONOO−-სთან ძალიან სწრაფად მიმდინარეობს. აქედან გამომდინარე ფიზიოლოგიური რეაქციების მიმდინარეობისას ONOO−-ს რეაქცია ნახშირბადის დიოქსიდთან სრულდება ნიტროზოპეროქსიკარბონატი წარმოქმნით (ONOOCO2−). ONOOCO2− თავისი მხრივ განიცდის ჰომოლიზს კარბონატის რადიკალისა და აზოტის დიოქსიდის წარმოქმნით. დროის დაახლოებით 66%-ის განმავლობაში ეს ორი რადიკალი თავიდან ერთდება ნახშირბადის დიოქსიდისა და ნიტრატების წარმოქმნით. დანარჩენ დროს ისინი იხსნებიან გამხსნელში და წარმოქმნიან თავისუფალ რადიკალებს. სწორედ ეს რადიკალები (კარბონატისა და აზოტის დიოქსიდის) წარმოადგენენ მიზეზს, რის გამოც პეროქსინიტრიტს უჯრედის დაზიანება შეუძლია.
პეროქსიაზოტოვანი მჟავა რედაქტირება
იხილეთ აგრეთვე რედაქტირება
სქოლიო რედაქტირება
- ↑ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ W. H. Koppenol
- ↑ Pacher, P.; Beckman, J. S.; Liaudet, L.; "Nitric Oxide and Peroxynitrite: in Health and disease" Physiological Reviews 2007, volume 87(1), page 315–424. doi:10.1152/physrev.00029.2006 PMID 17237348
- ↑ Csaba Szabó, Harry Ischiropoulos and Rafael Radi; "Peroxynitrite: biochemistry, pathophysiology and development of therapeutics" Nature Reviews Drug Discovery; 6, 662–680 (August 2007). დაარქივებულია ორიგინალიდან — 2011-07-21. ციტირების თარიღი: 2017-04-09.
- ↑ Beckman, J. S.; Koppenol, W. H. "Nitric Oxide, Superoxide, and Peroxynitrite: the Good, the Bad, and Ugly" American Journal of Physiology – Cell Physiology 1996, volume 271, page C1424–C1437.